- 分類:癌症治療新知
- 作者 陳駿逸
- 點擊數:529
抗PD-1、BRAF 和 MEK三藥組合 治療BRAF V600E突變大腸直腸癌
一項發表於2023年Nat. Medicine期刊(Nature Medicine volume 29, pages458–466 (2023))之第二期的臨床試驗評估BRAF V600E突變的大腸直腸癌且接受過至少一種治療的患者,探討並評估給予BRAF抑制劑、MEK抑制劑搭配免疫治療(dabrafenib/ trametinib /sparatlizumab -PDR001)的療效。
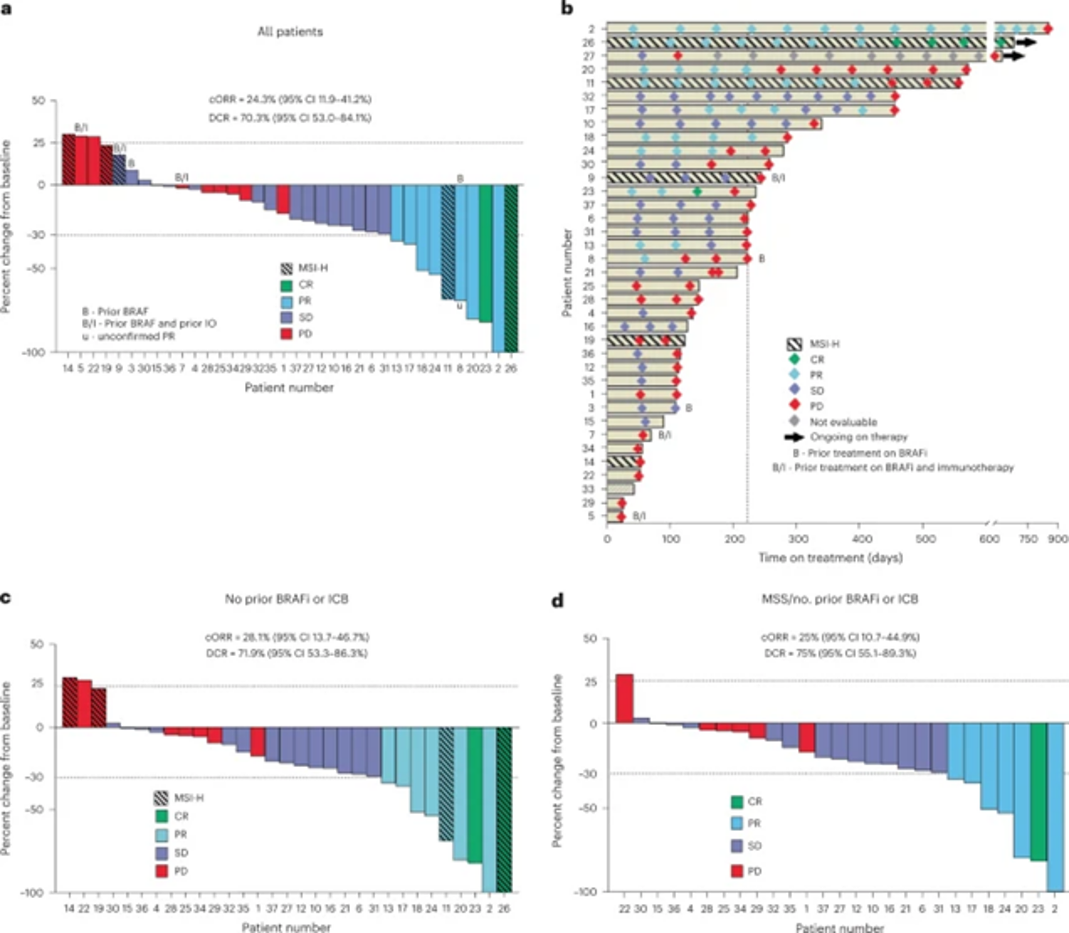
該臨床試驗共入組37名患者。確認為治療後的腫瘤緩解率為24.3%,疾病控制率為70.3%;其中32名為微衛星狀態穩定患者的治療腫瘤緩解率為28.1%, 疾病控制率為71.9%。
而未接受過BRAF標靶藥物和免疫治療的微衛星狀態穩定患者中,抗PD-1、BRAF 和 MEK三藥組合治療後的腫瘤緩解率為25%,疾病控制率為75%。與過去已經接受過BRAF標靶治療的患者相比,是具有優勢的。
在既往沒有 BRAF標靶治療過的患者,給予PD-1、BRAF 和 MEK 抑制劑的三藥物組合的治療有效率近乎25%,相較於BRAF/MEK抑制劑的組合的歷史數據之7%讓,狠狠地增加了超過三倍。這治療有效率也優於 encorafenib與cetuximab組合的 20%,而encorafenib與cetuximab的治療組合是當前FDA核准的 BRAFV600E 大腸癌的標準治療。 PD-1、BRAF 和 MEK 抑制劑的治療組合還觀察到疾病控制時間增加的證據,中位 PFS 為 5 個月(而使用 BRAF/MEK雙藥物組合僅 3.5 個月),有57% 的患者繼續治療時間超過6 個月,18% 的患者繼續治療時間超過 1 年。
通過對治療前後的樣本進行分析,發現與疾病控制時間(PFS)<6個月相比,其PFS>6個月患者的CD45免疫細胞、T細胞和CD8 T細胞增加,腫瘤上皮細胞顯著減少。
同時腫瘤的差異表達基因分析發現,PFS>6個月患者的免疫相關基因表達顯著增加,包括參與干擾素反應、抗原加工和呈遞,以及趨化因子活性的基因。
而PD-1、BRAF 和 MEK 抑制劑的三藥物組合,藉由抑制MAPK 訊號通路會觸發腫瘤細胞內在誘導關鍵的免疫程序(I 型和 II 型 IFN 反應、抗原呈遞基因和 T 細胞募集趨化因子)。 這些基因表達變化類似於免疫活性高的 MSI -H大腸癌的惡性細胞中發現的基因表達程序,並且與活化和長期刺激的 T 細胞有相關,MSI -H大腸癌會受惠於PD-1的免疫治療。所以,腫瘤細胞內在機制的研究支持了 BRAF/MAPK 訊號通路的啟動活化,會促進腫瘤細胞內的免疫抑制信號,而這些信號恰恰可以通過BRAF 和 MEK標靶藥物去靶向通路的抑制來逆轉。
#PD-1
#BRAF
#MEK
#BRAF V600E突變
#大腸直腸癌
#dabrafenib
#trametinib
#sparatlizumab
#PDR001
#微衛星狀態穩定
