- 分類:癌症治療新知
- 作者 陳駿逸
- 點擊數:3479
抗癌新戰略-斷其糧草 抑制癌細胞的麩醯胺酸酶(Glutaminase)
狡詐癌細胞 讓體內代謝反叛
癌細胞也是我們自己體內的細胞,它是由正常細胞變異而成的活物,熟知免疫系統內建的安全機制。因此當癌細胞遇見免疫系統時,會像正常細胞一樣,分泌出讓免疫系統關閉的信號蛋白,踩住免疫煞車,讓免疫反應停擺、放過癌細胞。當然癌細胞也熟知體內原本的代謝機制,為了生存及擴大地盤,它還有一個重要特徵就是善用體內原本的代謝機制並將其重新設定適合癌細胞生存的代謝,以支持癌細細胞所需要的快速增殖,癌細胞重新設定適其合生存的代謝主要是透過特殊的腫瘤代謝產物 (oncometabolite) 所介導的轉化機制或活化致癌基因來進行,本文會以腎細胞癌(RCC)為例子,探討腎細胞癌如何全面性地影響細胞能量的產生以及癌細胞如何利用葡萄糖和麩醯胺酸(Glutamine ),了解癌細胞藉由麩醯胺酸之供應以支持其癌細胞的生長和增殖。麩醯胺酸酶是一種麩醯胺酸代謝中的重要酵素,目前已經研發出新型的麩醯胺酸酶抑制劑,針對癌細胞以麩醯胺酸當作主要能量來源的高度依賴性,去進行抗癌治療,目前已經嘗試作為轉移性腎細胞癌的治療策略,目前2期研究看起來此舉似乎是可行。到底癌細胞的麩醯胺酸代謝途徑以及細胞利用麩醯胺酸的變化,是如何使癌細胞得以增生,應該探討其科學依據有甚麼,而麩醯胺酸酶抑制劑抗腫瘤的功效和分子機制也有需要了解,目前正在進行的臨床試驗結果又是如何,是否可以藉由抑制癌細胞酶,作為當前癌症患者治療的藥物,也值得省思。
麩醯胺酸目前臨床的角色
臨床上有很多癌症病人因為口腔黏膜發炎,而服用價錢不斐的麩醯胺酸,此舉到底是否有效?從實證醫學觀點而言,答案似乎不甚肯定其功效。目前有幾篇綜合論述或回顧性的文章的結論,都說是否該癌症病人該常規補充麩醯胺酸,這點仍然有高度爭議,除了有本文所論述的疑慮之外,最重要是目前並無大型雙盲、隨機性臨床試驗探討這個議題,實證醫學是要求需要更強大的證據才能正確地回答這個問題。目前來說癌症病人因為同步放射與化療所引起的口腔黏膜發炎,研究結論之證據強度是支持於發生後才補充麩醯胺酸。而使用補充麩醯胺酸預防化療引起之周邊神經病變,從實證醫學觀點而言,答案也是不甚肯定其功效也是因為目前並無大型雙盲、隨機性臨床試驗支持這個做法。
目前認為麩醯胺酸 是癌細胞最主要的營養與能量來源,轉化癌細胞後反而變成以麩醯胺酸當作主要能量來源的高度依賴性,又稱為Glutamine addiction,
讓癌細胞飢餓 癌症治療新方向
最近癌症治療的研究方向,轉向讓癌細胞飢餓的方向,當然抑制癌細胞使用麩醯胺酸,變成一個重要的手段,麩醯胺酸酶是一種麩醯胺酸合成代謝中的重要酵素,目前已經研發出新型的麩醯胺酸酶抑制劑中,基礎實驗都有良好的結果,且已經進入臨床試驗階段。
知己知彼
麩醯胺酸是一種非必需胺基酸,可以被體內所有細胞合成和代謝。麩醯胺酸參與人體的各種生理功能,不僅僅只有癌細胞。這個事實對於以後針對麩醯胺酸途徑作為治療標的的抗癌治療,為何早期的嘗試出現失敗是特別重要。因此,首先回顧麩醯胺酸在機體和細胞中的生理作用。
麩醯胺酸是血漿中最豐富的胺基酸,它是器官間的碳和氮運輸所需要的通用載體,本質上,它是人體的“Wild Card”(也就是外卡,在撲克牌遊戲中是指可當任意牌用的「萬用牌」)胺基酸。麩醯胺酸的大部分是由骨骼肌,脂肪細胞和肺組織自己產生的,它們維持了整個生物體的麩醯胺酸之恆定狀態。當麩醯胺酸需求量超過身體的生物合成能力時,例如在傷口修復過程或敗血症,麩醯胺酸就成為身體特別需要的氨基酸。
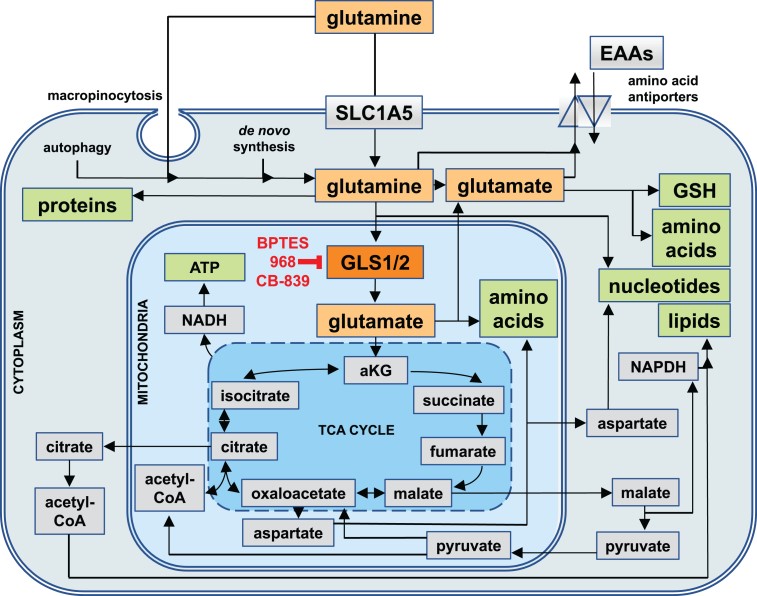
在細胞中,麩醯胺酸被當作其他胺基酸、代謝產物、核苷酸、脂質、蛋白質的生物性合成所需要的“燃料”,並以三磷酸腺苷(ATP)的形式產生能量。因此,由於對大分子的構建基塊和能量的需求很高,快速分裂的細胞通常會使用大量的麩醯胺酸當作主要的營養與能量來源,例如小腸的上皮細胞、免疫細胞(例如活化的淋巴細胞)以及癌細胞 。如果細胞內的麩醯胺酸自我合成不足,無法滿足細胞對麩醯胺酸的需求,則可以通過溶質載體(SLC)家族(特別是SLC1A5,見圖)的麩醯胺酸轉運蛋白將其導入細胞質,巨胞飲作用(macropinocytosis,通過胞吞作用攝取細胞外液的大量空泡),甚至通過大分子的細胞內分解釋放(又稱作自噬)。
麩醯胺酸的細胞內命運可以分為兩大類:
- 細胞質和粒線體(見上圖)。在細胞質中,麩醯胺酸可用於蛋白質和核苷酸的生物合成,也可用於反轉運蛋白的出口,反轉運蛋白可以作為一種類似“貨幣”的角色去交換其他胺基酸。此外,細胞質內麩醯胺酸衍生的麩胺酸是許多胺基酸、六胺(信號蛋白糖基化的前體)和穀胱甘肽的重要前驅物質。
- 在粒線體中,麩醯胺酸酶1和2(GLS1和GLS2)將麩醯胺酸轉化為麩胺酸和氨摩尼亞。麩胺酸然後成為胺基酸生物合成的主要品,或轉化為α-酮戊二酸(aKG),後者進入三羧酸(TCA)循環-細胞代謝的中心樞紐,可以相互轉化許多生物合成反應的前驅物(見上圖)。 )。在TCA週期中,麩胺酸以NADH(通過氧化磷酸化合成ATP所需)和NADPH(脂質和核苷酸的生物合成以及細胞質穀胱甘肽的再生所需)。最後,麩醯胺酸衍生的麩胺酸可以透蘋果酸和丙酮酸生成乙酰輔酶(Aacetyl-CoA),從而“助長” TCA循環。。
因此,麩醯胺酸是幾乎所有細胞代謝物、大分子和能量的碳,氮和電子的主要來源。
當葡萄糖不能完成工作時 癌細胞將高度仰仗麩醯胺酸和麩醯胺酸酶的作用
癌細胞依賴於細胞外麩醯胺酸和麩醯胺酸活性的分子機制,有助於提供了針對該特定代謝途徑的治療原理。
自1950年代以來,麩醯胺酸的攝取增加和麩醯胺酸酶的表達,被認為是體內、外實驗中腫瘤細胞增殖的標誌。隨後在腎細胞癌的細胞研究也證實,麩醯胺酸有高度消耗的情形。
腎癌最常見的亞型是透明細胞型(ccRCC),除了正常的腎臟組織外,據報導腫瘤中的麩醯胺酸和麩胺酸水平更高,此外還增加了麩醯胺酸的輸入器如SLC1A5的表達。去除麩醯胺酸的早期研究表明,即使在葡萄糖充足的條件下,某些癌細胞株仍需要依賴麩醯胺酸提供能量。涉及基因擾動的其他研究也進一步表明,許多腫瘤的增生都依賴麩醯胺酸活性,因此暗示癌細胞對麩醯胺酸有成癮的現象,也就是癌細胞對麩醯胺酸需求增加的結果。
麩醯胺酸酶是一種將麩醯胺酸轉化為麩胺酸的粒線體酶,通常以GLS1和GLS2兩種同工酶的形式存在,由基因GLS1和GLS2編碼。 GLS1有兩個剪接變體,即腎型麩醯胺酸酶(KGA)和較短,活性更高的變體-即麩醯胺酸酶C(GAC)。兩種剪接變體均在組織中廣泛表達,尤其是GAC變體在腫瘤細胞中的表達水平要高於相應的正常細胞。
在正常細胞的體外培養條件下,葡萄糖和麩醯胺酸都是細胞代謝的豐富資源,並且在TCA循環中“推動”相同的代謝途徑。這一事實提出了一個問題:為什麼癌細胞在葡萄糖存在下,還需要依賴麩醯胺酸?致癌轉錄因子HIF(缺氧誘導因子)通常在癌細胞中通過灌注不良的實體瘤區域中的缺氧,或是通過其他癌基因的活性而被激活,在這種現像中HIF起著核心作用。
在腎癌中,VHL和果糖1,6-雙磷酸酶1(FBP1)的腫瘤抑制功能喪失,部分腎癌具有此特徵,會導致幾癌細胞的HIF活性增加,但與低氧無關。 HIF通過增加葡萄糖轉運蛋白和糖酵解酶的表達,來重新編排細胞的代謝,並增加葡萄糖攝取和糖酵解。此外,HIF還將TCA循環從主要的葡萄糖利用,轉變由麩醯胺酸為為主要燃料的系統。在正常細胞中,葡萄糖衍生的碳通過丙酮酸進入粒線體,從而以“順時針”方式驅動TCA循環(見上圖)。但是,即使腎癌細胞顯示出更高的糖酵解作用,但增加的HIF活性仍會抑制丙酮酸脫氫酶(PDH)和丙酮酸羧化酶(PC)活性,從而導致葡萄糖衍生的碳進入TCA循環的速度大大降低。因此,這些細胞主要通過麩醯胺酸衍生的麩胺酸,透過aKG還原羧化為異檸檬酸,而沿著TCA循環的“逆時針”方向“提供燃料”(見上圖)。癌細胞對麩醯胺酸有成癮的現象,就會沿這個“反向”方向進行TCA循環,以生成檸檬酸鹽和蘋果酸用於脂質生物合成,並生成草酰乙酸用於核苷酸生物合成,同時其大部分能量來自糖酵解。 腎癌中的HIF活化,對於增加麩醯胺酸的利用和依賴性既是必需的,這既可以通過限制葡萄糖為TCA循環“加油”的能力,又可以通過重新排程麩醯胺酸的代謝來提供維持快速分裂細胞不斷增長的需求所需的必需大分子。
癌細胞中的代謝重排現象和麩醯胺酸依賴程度,隨著腫瘤的進展和侵襲性的發展而增加,並積累其他癌症基因和抑癌基因的變化,例如磷酸肌醇3激酶(PI3K),c-MYC或p53。
有趣的是,活化HIF似乎並不會影響麩醯胺酸轉運蛋白或GLS1的表達或蛋白質水平。這也說明即使是正常細胞,也已經有能力將麩醯胺酸用作TCA循環的主要“燃料”,但更喜歡使用葡萄糖。相比之下,癌細胞因為活化了HIF,因此失去了將葡萄糖用作主要TCA循環“燃料”的能力,從而轉化成特別依賴麩醯胺酸的情形。這可以解釋為什麼與正常細胞相比,透過麩醯胺酸抑制干擾谷氨酰胺利用的原因,應該可以對癌細胞產生負面影響。
而在遺傳性平滑肌瘤病和腎細胞癌(HLRCC)症候群,患者發生具有乳頭2型組織學的腎臟腫瘤,這一類腎癌細胞在TCA週期中缺乏功能性酶富馬酸鹽水合酶(fumarate hydratase ,FH),該酶將富馬酸鹽轉化為蘋果酸鹽(malate,見上圖)。 FH缺乏會引起富馬酸鹽的積累,從而穩定了HIF蛋白,這些細胞表現出糖酵解活性的增加,並依賴葡萄糖和麩醯胺酸來促進細胞增殖和存活。
同樣,在另一種家族性和散發性的琥珀酸脫氫酶(succinate dehydrogenase ,SDH)缺陷型腎癌中,缺少功能性酶SDH,該酶在TCA循環中將琥珀酸轉化為富馬酸酯。與缺乏FH的細胞相似,缺乏SDH的細胞也表現出HIF活性增加,以及糖酵解與麩醯胺酸的利用率增加。
最終,由c-MYC驅動的集尿管型腎癌,一種由腎臟集尿管系統的上皮細胞引起的腎癌,具有高度侵略性,也證明其麩醯胺酸利用率增加。因此,與透明細胞型腎癌一樣,即使對於某些非透明細胞類型的腎癌,麩醯胺酸抑制也可能是可行的藥物作用標的。總之,在所有類型的腎癌,廣泛性的細胞代謝重排是一個共同的主題,麩醯胺酸衍生的麩胺酸鹽在TCA循環中發揮著核心作用,可產生足夠量的中間物質,用於脂質、核苷酸和其他氨基酸的生物合成,以及用於維持氧化還原穩態的NADPH。 無論是癌細胞,還是任何具有激活的HIF的癌細胞,他們使用葡萄糖驅動TCA循環的能力是有限的,這也為這些癌症中麩醯胺酸的能量高度依賴性提供了合理的解釋,因為這種代謝策略為癌細胞提供了生成所需要之碳和氮替代性的來源。
麩醯胺酸酶抑制劑的抗腫瘤作用:臨床前數據和分子機制
癌細胞依賴於麩醯胺酸酶的活性,這表明維持細胞內麩醯酸的供應是需要麩醯胺酸。儘管長期以來人們認為麩醯胺酸成癮的癌細胞,是需要麩醯酸來產生足夠的能量提供其增殖和存活,但最近的研究表明,ATP的產生似乎並不是癌細胞增殖的主要限制因素,而主要限制因素是源自於麩醯胺酸的麩胺酸在TCA循環中的核心作用,如此才能產生脂質、核苷酸、其他胺基酸和NADPH的生物合成所需的足夠的中間體。選擇性麩醯胺酸酶抑制劑,可以針對癌症麩醯胺酸依賴性這一核心問題解決。:
針對麩醯胺酸新陳代謝的人體研究
值得注意的是,一些FDA核准對麩醯胺酸利用的藥物,其脫靶效應反而意外顯示出對麩醯胺酸抑制確實有助抗癌。例如,細菌L-天冬酰胺酶被用於治療急性淋巴細胞白血病(ALL),並且可以代謝天冬酰胺和麩醯胺酸,從而消耗血漿麩醯胺酸水平。Sorafenib是一種FDA批准用於晚期肝癌與腎癌的的多酪氨酸激酶抑製劑(TKI),最近研究也指出其可以抑制了胱氨酸/麩胺酸酶逆轉運蛋白SLC7A11 / xCT。
然而更具體地針對麩醯胺酸酶抑制/麩醯胺酸酶抑制途徑的嘗試,早在1980年代就開始了。開發出麩醯胺酸類似物,例如6-重氮基5-氧代-L-正亮氨酸(6-diazo-5-oxo-L-norleucine ,DON)、azaserine與acivicin和,以競爭性方式去結合麩醯胺酸轉運蛋白,從而抑制細胞吸收麩醯胺酸。acivicin在一項臨床試驗中被測試用於治療轉移性腎癌,這藥物在臨床前實驗中顯示出很高的療效,但研究證明對患者的治療作用較小,客觀緩解率只有4%,但對腦、骨髓和胃腸道具有高度毒性。麩醯胺酸在神經傳導物質的生物發生和迅速分裂的正常細胞的代謝中起關鍵作用的背景下,可以理解麩醯胺酸抑制劑為何會有這些不良反應,但是這些藥物的功效有限,以及有嚴重的毒性,讓針對麩醯胺酸代謝在長期的癌症治療中成為較不理想的標的。
但是日後對麩醯胺酸酶在細胞麩醯胺酸利用的重要性以及癌細胞對GLS1依賴性的知識與時俱增,重新激發了針對麩醯胺酸代謝用於抗癌的興趣,並導致開發用於癌症治療的選擇性麩醯胺酸酶抑制劑。但GLS1抑制劑BPTES和968在水溶液中的溶解度很差,治療效力有限,因此阻礙了它們在臨床上的應用。有關與GLS1結合的這些藥物的結構信息的可得性,導致醫界努力將BPTES合理地演化為更有效和穩定的、具有更好溶解性的類似物。例如,BPTES類似物UPGL00004是GLS1的GAC變體的有效抑制劑,比BPTES更有效,當與抗血管內皮生長因子(VEGF)抗體bevacizumab聯合使用時,可以抑制小鼠乳癌的生長。目前還探索了通過納米顆粒的遞送藥物,從而改善了BPTES的藥代動力學和功效。與GLS抑制劑並行,目前已經開發出麩胺酸脫氫酶(GLUD)抑制劑。 GLUD催化在GLS的下游,將麩醯胺酸轉化為aKG和氨的反應。
在下一代GLS抑制劑中,具有更高生物利用度的新型化合物telaglenastat (tela; CB-839)是迄今為止唯一已通過臨床試驗的藥物。在血液腫瘤和包括腎癌在內的各種實體瘤中,它已作為單一藥物或已建立的療法進行了測試。在轉移性腎癌的早期研究中,telaglenastat (tela; CB-839) 具有良好的耐受性並具有令人鼓舞的臨床活性。telaglenastat (tela; CB-839)單一療法對21例轉移性腎癌患者產生了部分緩解(療效持續356天),並且有52%的患者病情穩定。此外,telaglenastat與其他藥物合用似乎也具有良好的耐受性。在此介紹telaglenastat中於轉移性腎癌之第三線治療的隨機性第二期臨床試驗之研究結果,這些患者皆使用過超過1種的VEGFR標靶藥物,且體能尚可。根據先前的標靶藥物和MSKCC的風險等級對點進行分層,並按2:1的比例隨機接受口服telaglenastat 每日2次、一次800μmgPO或是安慰劑之對照組,治療直到疾病惡化/或因毒性無法耐受為止。主要終點是研究者評估的疾病無惡化生存期(PFS)。研究結果顯示,telaglenastat治療組的中位PFS為3.8個月,安慰劑之對照組的中位PFS只有1.9個月,telaglenastat治療可以減少36%的疾病惡化風險。最常見的是嚴重副作用,貧血(telaglenastat治療組與對照組分別是17%、 17%),肺炎(telaglenastat治療組與對照組分別是7%與4%),腹痛(telaglenastat治療組與對照組分別是7%與 0%),血小板減少症(telaglenastat治療組與對照組分別是7%與 0%),疲勞(telaglenastat治療組與對照組分別是4%與 9%)。因副作用引起的停藥率相似(telaglenastat治療組與對照組分別是28%與30%)。沒有與治療有關的死亡。亞組分析與主要分析一致。2019 年美國臨床腫瘤年會上也發表了Telaglenastat合併MET標靶藥 Cabozantinib 在轉移性腎癌的第一期臨床試驗,也有很好的療效。因此,麩醯胺酸酶抑制劑代表了臨床上針對癌細胞麩醯胺酸代謝的新一類藥物,至少已經在轉移性腎癌的治療方面有望取得早期成果。
結論
癌細胞由於個別因素,干擾體內生長環境之代謝,將生化代謝路徑給予重新設定,並且同時改變葡萄糖和麩醯胺酸的利用率,讓癌細胞高度仰賴於外源性麩醯胺酸的供應。麩醯胺酸在癌細胞內被麩醯胺酸酶轉化為粒線體中的麩胺酸,用於生成TCA循環中間物質,這是癌細胞內胺基酸;脂質、核苷酸和抗氧化劑的生物合成之重要基礎。 目前已知許多癌細胞對麩醯胺酸呈現高度依賴,甚至達到成癮的等級,這也是該類癌細胞之代謝的“致命弱點”。麩醯胺酸進入細胞內後,粒線體內的麩醯胺酸酶會將麩醯胺酸分解運用,這也導致很多癌細胞的麩醯胺酸酶濃度比正常細胞的麩醯胺酸酶濃度要高,這個現象成為治療癌症的新標的,也就是抑制癌細胞的麩醯胺酸酶,使癌細胞沒有麩醯胺酸可以使用,讓癌細胞飢餓。而體外和體內研究指出麩醯胺酸酶抑制劑可以導致癌細胞增殖減少,這可以說是是應對這種“致命弱點”的有效抗癌方法。單獨使用麩醯胺酸抑制劑telaglenastat或與其他藥物聯合,於治療轉移性腎癌的臨床試驗結果吸睛,這類新型藥物具有良好的耐受性,並在某些情況下能夠控制疾病。目前還有第一期臨床試驗證明用Telaglenasta搭配化療Paclitaxel ,可以加乘化療其抑制三陰性乳癌的作用;不只如此,動物實驗也發現Telaglenasta搭配PARP 標靶藥物,也有抑制三陰性乳癌的作用。甚至動物實驗也發現 Telaglenastat 搭配CDK 4/6 標靶藥物,可以抑制荷爾蒙受體陽性的乳癌,於2019年6月已經開始Telaglenastat搭配CDK 4/6 標靶藥物在固體癌症治療的早期臨床試驗。 然而,目前還需要找出生物標記物來識別從麩醯胺酸抑制劑治療獲益最大的患者,並在治療過程中儘早檢測出治療反應和抗藥性。
想要閱覽作者撰寫的更多癌症資訊,歡迎前往台中市全方位癌症關懷協會官網http://www.cancerinfotw.org/,並懇請各位能夠加入協會官方facebook粉絲團,將愛心關懷與知識的力量傳遞出去。加入粉絲團可以定期閱讀到官網精選文章、醫學教育影片,並且每個月都可以接到協會的電子報專題報導,讓癌症新知「不遺漏」
想要瞭解作者的資訊也請至http://cancerfree.medicalmap.tw/點閱”陳駿逸醫師簡介”
相關醫療服務資訊:陳駿逸醫師門診服務時段 (2019.09.01公告) http://cancerfree.medicalmap.tw/bencandy.php?fid=156&aid=4162
癌友必備專書 聰明擊退癌疲憊 讓你抗癌事半又功倍
https://www.commonhealth.com.tw/book/bookTopic.action?nid=37
延伸閱讀:
