- 分類:陳駿逸醫師的話聊俱樂部
- 作者 癌症新觀點/話聊俱樂部 陳駿逸醫師
- 點擊數:1209
溫熱治療在當今的醫療體系何去何從??
文:癌症新觀點/話聊俱樂部/茱麗葉乳醫集團 陳駿逸醫師
溫熱治療(hyperthermia)被定義為利用外源性的熱能誘導來應用於治療,這是一個相當古老而非新鮮的概念,可以追溯到古代,當時熱就被用於治療各種疾病,包括腸胃炎,心臟病、甚至是感冒及惡性腫瘤。
由於各種研究已經證實了溫熱治療的潛在分子作用機制,因此在過去的幾十年,這種治療策略變得用於癌症的治療變得更加流行。
一般而言,溫熱治療在結合化療、免疫、標靶和/或放射線的治療方案中,被用作為輔助的治療,化療或放射線治療這兩種方法,都可以誘導不可逆的癌細胞 DNA 損傷。根據許多體外、體內和臨床研究,溫熱治療已經被證明也可以通過干擾 DNA 修復反應,來增強 DNA 靶向的癌症治療策略,偕同增加化療或放射線的治療的有益效果。
溫熱治療的溫度是在 40 到 44°C 之間,它是一種多方面的治療方式。也是一種有效的放射線治療的增敏劑,與許多化學治療劑有良好的相互加乘作用,並且若與放射治療相結合搭配,可以加強放射治療的類似“原位腫瘤疫苗接種”的免疫調節效應。
溫熱治療在當今的癌症治療體系何去何從?
簡單地說。溫熱治療是可以與其他抗癌治療方法有相互的作用,在化療、免疫、標靶和/或放射線治療的方案下,與溫熱治療可以互相結合。
溫熱治療是一種有效的放射治療增敏劑
放射治療可以單獨或是與其他治療方式聯合作為治療癌症的主要方法之一。據估計,45-55% 的新診斷癌症患者都需要放療,另外 10% 的患者終其一生中是需要再放療 ,有40% 的癌症治癒是歸功於放療。
放射治療的主要目的是透過向腫瘤輸送殺瘤劑量去誘導癌細胞的 DNA 損傷,同時最大限度地減少對正常組織的劑量。目前放射治療已經有計劃、執行和監測之許多方面的進步,導致了現代的放療既安全又有效。然而,放療有一些固有的限制仍然存在,主要如下: (a) 內在 DNA 的修復機制可以防止癌細胞因受到放療所致的致死損傷轉化為亞致死和潛在性致死損傷,從而減少對腫瘤細胞的殺傷; (b) 缺氧的腫瘤細胞存在著對放射治療的抵抗性; (c) 處於合成期的腫瘤細胞本質上是抗放療的; (d) 增加放療劑量雖然可以增強腫瘤控制,但也可能導致急性和晚期正常組織發病的風險更高。因此,目前為改善放射治療效果而進行的各種不同嘗試中,尋找合適的放射增敏劑和輻射調節劑是積極研究的領域之一。
溫熱治療已知是最有效的放射治療增敏劑之一,它結合了誘導腫瘤基質的熱生理變化以及細胞與分子水平的持續性之可相互作用
溫熱治療與放射治療相互作用的影響總結如下:
- 1.熱療強化放射治療:
原則上,熱療強化放射治療增敏現象對正常組織和腫瘤組織都有影響。
熱療強化放射治療的增強率取決於癌症組織類型、溫度、加熱時間以及加熱和放射之間的時間間隔。溫熱治療的溫度越高,加熱時間越長,增強作用越大。
當同時進行溫熱治療和放射治療時,熱療強化放射治療的增強率則是最高,與熱療劑量成比例線性關係,甚至可能達到 5 倍的增強,但它對於腫瘤和正常組織也達到相似的值。因此,同步溫熱治療和放射治療強化前提下,是需要放射治療精確地勾勒腫瘤的靶點以實現腫瘤的高選擇性。隨著溫熱治療和放射治療之間的時間間隔增加,無論它們的順序是如何,熱療強化放射治療的增強率在腫瘤組織中會下降大約 2 倍,在正常組織中下降大約 1倍。因此,臨床上通常是依次序給予溫熱治療後再接放射治療,並且認為溫熱治療和放射治療之間的越短時間的間隔是最佳的,因為它會產生有效和具有腫瘤選擇性的放射增敏作用。因為腫瘤選擇性的進一步增強,所以腫瘤周圍正常組織邊緣的溫度通常較低。
處於合成期的腫瘤細胞本質上是抗放療的,但反而是對溫熱治療敏感。在>41°C 的溫度下,溫熱治療還會暫時抑制癌細胞受到放療所誘導的亞致死和潛在致死 DNA 損傷而進行的修復 。在臨床上,放療誘導的 DNA 損傷得到修復之前,利用溫熱治療這種機制,來干擾癌細胞DNA 損傷的修復,是需要提高腫瘤溫度與所短溫熱治療和放射治療之間的時間間隔。
溫熱治療會藉由誘導 BRCA2蛋白的降解來抑制癌細胞遭受DNA 雙鏈斷裂時候所啟動的同源重組修復,BRCA2 是同源重組修復的關鍵。據報導,經典的非同源末端連接 (c-NHEJ) 和替代的非同源末端連接 (alt-NHEJ),其他主要的DNA 雙鏈斷裂的修復途徑,也部分會受到溫熱治療所影響,因為溫熱治療會讓重要的修復蛋白活性水平降低,包括 Ku、DNA-PK、KU70、KU80 和連接酶 IV。
在沒有修復活性的BRCA-2基因缺陷腫瘤細胞中,溫熱治療的也被證明還是一種有效的放射治療增敏劑,表明溫熱治療還是會誘導的其他 DNA 修復途徑的阻斷。由溫熱治療產生的 DNA 修復抑制會顯著降低腫瘤的 α/β 值,可以優化溫熱治)。因此,目前在許多臨床放療情況下(包括使用質子療法),採用放療大分割策略將大大使得放療受益於溫熱治療的加入。
溫熱治療後的生理性血管舒張也可以改善腫瘤灌注和氧合作用,進而促進放射治療的增敏效應,從而使抗放療的缺氧細胞轉變對放射治療具敏感性。這種效果需要相對較低、且腫瘤容易達到一定的溫度,大約 39°C。臨床數據表明,溫熱治療會導致部分腫瘤發生再灌流和再充氧,而這種再充氧會讓放療有更好的臨床結果。反而是將腫瘤溫度升高到 44°C或更高,可能導致腫瘤血管關斷,降低腫瘤氧合效應,導致臨床放療結果不良。 .
溫熱治療後,氧合效應增強的水平會持續到1-2天。而腫瘤血流的再灌注之發生取決於腫瘤的血管系統以及其對於溫度升高的反應之後的血管擴張能力。這種腫瘤特異性會讓溫熱治療和放射治療共用時候的強化效應,也讓溫熱治療和化學治療同用可以加強腫瘤內的藥物遞。
- 2.溫熱治療具有癌細胞的毒殺性:熱能可以通過各種機制殺死癌細胞,包括壞死和細胞凋亡。在缺氧的腫瘤細胞中,在不良微環境和低pH情況下加入溫熱治療可以將癌細胞毒殺。因此,溫熱治療誘導的細胞毒殺性的效果是溫度依賴性,但與溫熱治療和放射治療之間的時間間隔較無關聯。因此,溫熱治療所誘導的細胞毒殺性將有助於減少放射治療有抵抗性的癌細胞,並改善臨床治療成績。
- 3.熱治療的耐受性:溫熱治療期間誘導熱量,導致隨後的溫熱治療會使腫瘤組織產生暫時性的抵抗性,從而影響組織對後續溫熱治療的熱敏感性,這一現象歸因於熱休克蛋白,其通常於熱能壓力之後表達會上調。這蛋白質在普遍存在的細胞內部,並且當期釋放出來時也可以用於免疫力的調節,涉入對熱耐受性的形成。溫熱治療後初始腫瘤溫度越高,熱能恆定持續存在會越長。 臨床上,溫熱治療採取每週提供一次或兩次,用以避免由於過頻繁的熱能而導致熱治療的耐受性,造成無效的溫熱治療。
圖1:
臨床上的溫熱治療其溫度達到39-45℃下的多方面之特性作用,其效果是有效的放射治療的敏化劑; 與化學治療劑合用有獨立,添加和協同作用; 可以做為腫瘤免疫調節劑,是潛在的原位腫瘤疫苗免節劑; 及其具有搭胚有效載荷的磁性納米粒子的前景。
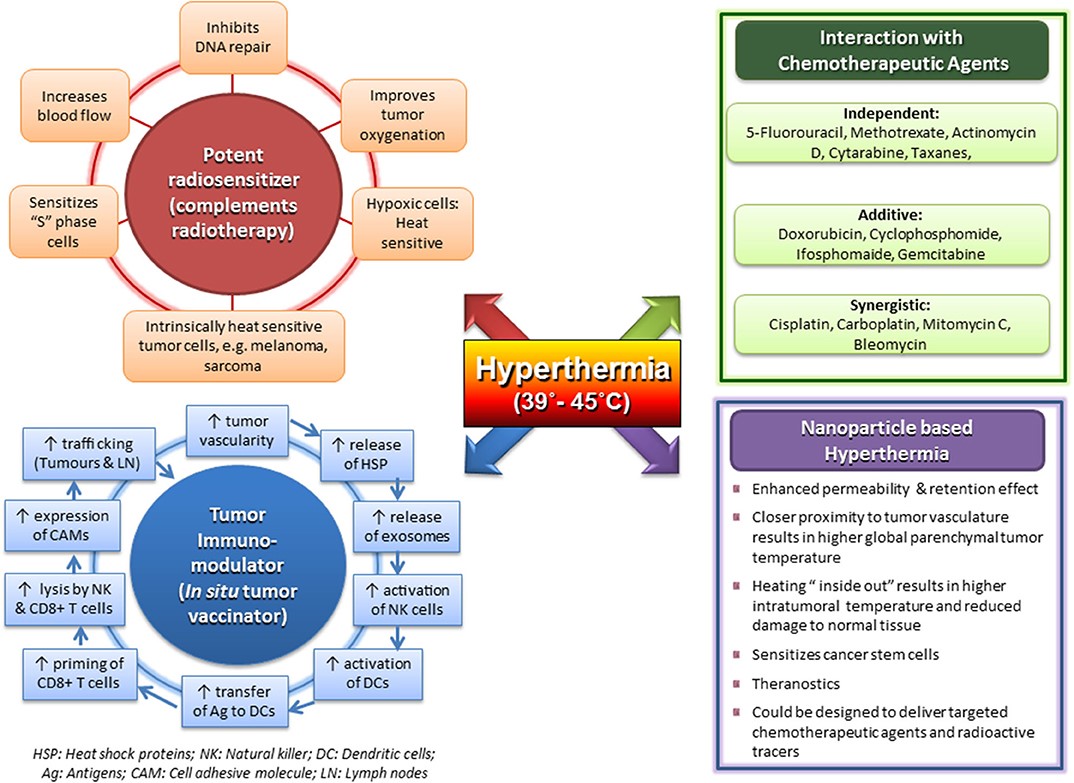
溫熱治療是理想的化療增敏感劑
通過溫熱治療改變化療的細胞毒殺性。體內和體外研究表明,許多化療藥劑在40.5-43℃下表現出細胞毒殺性增強。例如:BCNU、鉑金類、Oxaliplatin,和bleomycin。隨著溫度從37至41.5℃上升,導致細胞毒殺性增強。對於5-氟尿嘧啶(5-FU)mitomycin-C則不明顯。順鉑和奧沙利鉑顯示出超過41-42℃的溫度,就會迅速增加細胞毒殺性的倍率值,可能反是熱具有誘導干擾DNA損傷的修復的協同作用,類似於與放療的協同作用。
然而,對於胰臟癌細胞系中的體外研究表明,當給予化療gemcitabine24小時後進行溫熱治療時,化療的熱敏感強化是最佳的。
此外,細胞毒殺性藥物會觸發靶向藥物的遞送系統,可以確保更有效的藥物遞送,避免快速代謝,微脂質體包覆化療藥物是為了增加了其循環的半衰期。微脂質小紅莓被設計為利用由於腫瘤的洩漏脈管系統會增強的滲透率和保留效應,讓這些藥物被動性的積累。然而,已經發現這種被動藥物靶向在腫瘤組織內達到的濃度不足。但這可以通過在腫瘤部位的溫熱治療讓這些高溫度敏感的微脂質體觸發其釋放來改善藥物濃度,從而允許更高的局部藥物濃度,增加藥物滲透,並提高腫瘤內化療的生物利用度。從而最小化化療造成的正常組織毒性。
溫熱治療更是優質的免疫調節劑
已經證明了39-45°C的溫熱治療,可以調節先天和適應性的免疫系統,並於癌症免疫治療中加入會有協同作用。 溫熱治療觸發熱休克蛋白(HSP),特別是誘導腫瘤細胞釋放HSP70的免疫反應。在將腫瘤細胞暴露於較高溫度下,蛋白質聚集和變性誘導細胞中壓力反應,進行所謂的展開蛋白質反應。因而誘導了Hsp70的水平增加。
因為壞死的細胞失去了膜完整性,所以HSP會充當細胞外的危險信號。 且因為HSP和HSP /腫瘤抗原(AG)複合物都被釋放出來,含HSP和含腫瘤的外泌體也從腫瘤細胞排出,如此會激活並吸引樹突狀細胞(DCS),將其與CD8 + T細胞共刺激,從而通過引發細胞毒殺性T淋巴細胞(CTL),進而誘導T細胞的抗腫瘤免疫。
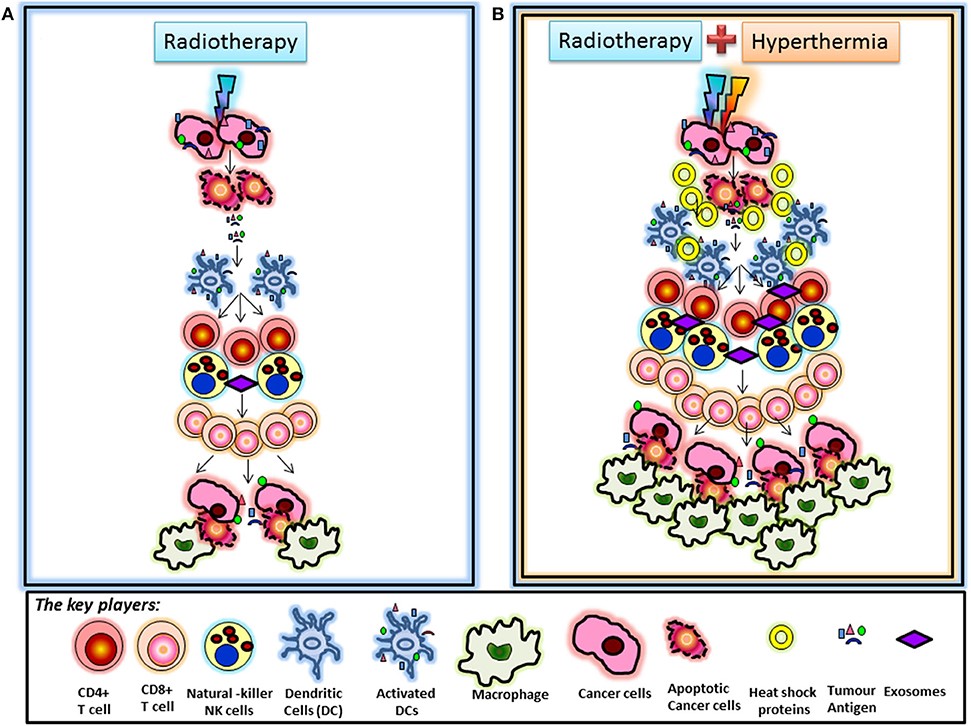
放療可以引發免疫抑制和免疫刺激。抗腫瘤的CD8 + T細胞已被證明是放療所誘導的免疫反應中的關鍵球員。而溫熱治療正可加速放療的免疫調節過程(圖2)。
圖2:放射治療與溫熱治療誘導的免疫調節:
- A.已知放療通過激活樹突狀細胞的激活,來介導其後的免疫調節,放射治療誘導的細胞死亡之後,從癌細胞釋放的腫瘤抗原,進而活化的樹突細胞後激活T細胞,導致一系列事件,最終導致細胞毒性CD8 + T細胞的刺激。通過放射治療誘導的趨化因子進一步促進最終通過巨噬細胞清除的腫瘤細胞。
- B.熱療和放療後的免疫調節:綜合熱療+放療會增加CD68 +巨噬細胞的浸潤,加速熱療對免疫調節的結果。眾所周知,熱療以及放射療法通過腫瘤細胞釋放熱休克蛋白,其可以作為額外的“危險信號”,進一步促進免疫反應。熱休克蛋白和含抗原的外泌體可能有助於樹突細胞的招募與聚集,導致該部分的免疫調節作用增強。這可能加速放射治療所誘導的免疫調節。當然這個現象與免疫治療合併下,更有功效。
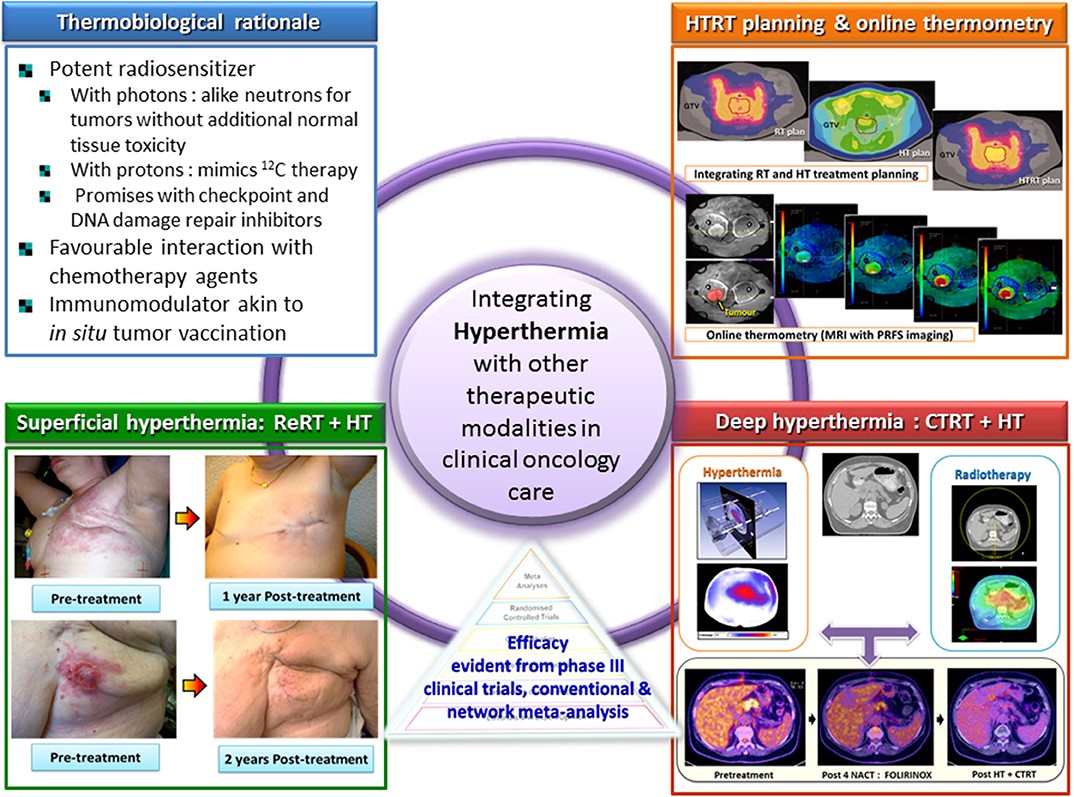
溫熱治療在臨床實務需要整合其他抗癌治療方式。
資料來源:Front. Oncol., 12 June 2020
#溫熱治療
#癌症
#癌症新觀點
#話聊俱樂部
#茱麗葉乳醫集團
#陳駿逸醫師
Hyperthermia
此處文章乃是醫療照護資訊的整理,請勿引據文章內容自行採取醫療決定;如有臨床治療之需求,建議還是應該尋求專業醫療人員的協助。
陳駿逸醫師醫療門診服務時段
http://www.cancerinfotw.org/index.php/nursing-rehabilitation/faq/1882-2021-09-13-14-32-19
知識就是力量(Knowledge is Power. )
給自己一個希望(Hope is something you give yourself. )
抗癌路上 你(妳)並不孤單
歡迎至Youtube訂閱癌症新觀點醫學教育頻道 幫助你贏在抗癌的起跑點
https://www.youtube.com/user/omegapeng
